의료 인사이트

‘세포자살’을 유도해 암의 비정상적인 증식을 억제하는 항암제는 암세포의 회피 능력을 높여 ‘내성’이라는 문제를 유발하기도 한다. 이에 최근 많은 연구자가 기존 단순 세포자살을 유도하는 치료에서 벗어나 새로운 세포사멸 경로 발굴에 집중하고 있다. 특히 세포 내 분자적 표적을 찾아 암을 치료하는 연구가 활발히 진행되고 있는데, 이를 통해 항암제의 내성을 극복할 수 있는 새로운 전략을 세울 수 있을 것이라 기대되고 있다.
암 치료의 새로운 패러다임
일반적으로 암은 생활습관, 식이습관 등에 따라서 다양한 부위에 발생할 수 있는데 특히 한국인에서 가장 흔한 암으로는 위암, 폐암, 간암, 대장암, 유방암, 갑상선암, 자궁경부암 등이 있다. 암 발생 원인은 다양하지만 크게 유전·환경적 요인이 작용하는 것으로 생각되고 있다. 최근에 많은 과학자가 기존 단순 세포사멸을 유도한 세포 치료와 달리, 세포 내 분자적 표적을 찾아 암을 치료하고자 하는 연구가 활발히 이루어지고 있다. 암세포의 비정상적인 증식을 억제하기 위한 대표적인 항암제의 경우 세포자살(Apoptosis)을 유도하고 이로부터 달아나기 위한 암세포의 회피 능력 때문에 항암제 내성이라는 문제가 발생한다. 따라서 항암제 내성을 극복하면서 효율적으로 암세포 죽음을 유도하기 위해서는 기존의 세포자살에서 벗어난 새로운 세포사멸 경로 발굴이 절실한 시점이다.
기존과 다른 형태의 암세포 죽음 프로그램 발견
최근의 연구를 통해 암세포의 죽음이 세포자살과 달리 염증반응을 동반한 ‘네크롭토시스(Necroptosis)’라는 전혀 다른 형태를 가진 죽음 프로그램의 존재가 규명되었다(그림 1). 본 연구팀은 네크롭토시스 활성화의 원인인 ‘RIPK1 인산화’를 조절하는 화합물을 천연물 추출물로부터 동정했다. ‘화합물 Rp-II’가 RIPK1를 중심으로 세포자살과 네크로톱시스 두 가지 죽음을 모두 가질 수 있는 소분자 화합물임이 본 연구를 통해 밝혀졌다. Rp-II는 세포에 들어가면 활성산소(ROS)를 만들게 되고, 이는 세포분자에 신호 전달되어 RIPK1의 인산화를 유도한다. 이것은 세포자살의 중요 촉매분자인 ‘Caspase-8 단백’을 활성화시켜 세포자살을 일으키게 된다. 또한 항암제 내성의 원인인 Caspase-8 기능 장애 세포에서는 RIPK1의 인산화를 바탕으로 네크롭토시스를 일으키기도 한다(그림 2). 이와 같이 약용식물 추출물로부터 소분자 화합물의 새로운 기능을 찾아감으로써 세포자살 조절 실패에 의한 항암제 내성암을 치료할 수 있는 새로운 전략을 제시할 수 있을 것으로 기대되고 있다. 
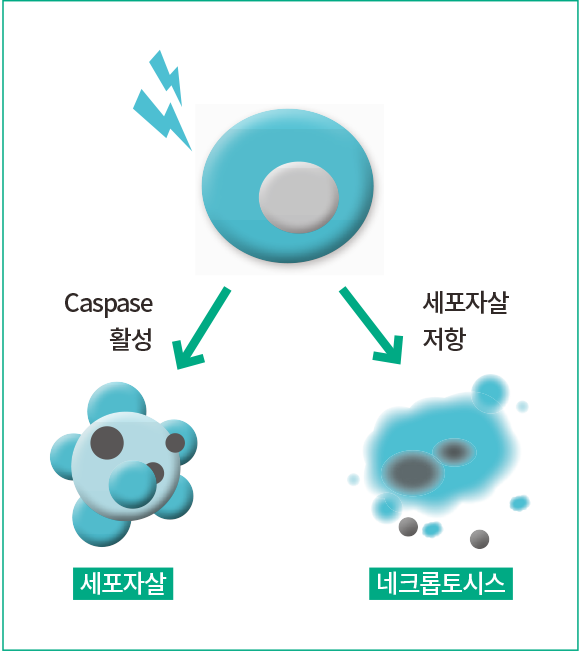 그림 1. 세포사멸의 새로운 전략
그림 1. 세포사멸의 새로운 전략
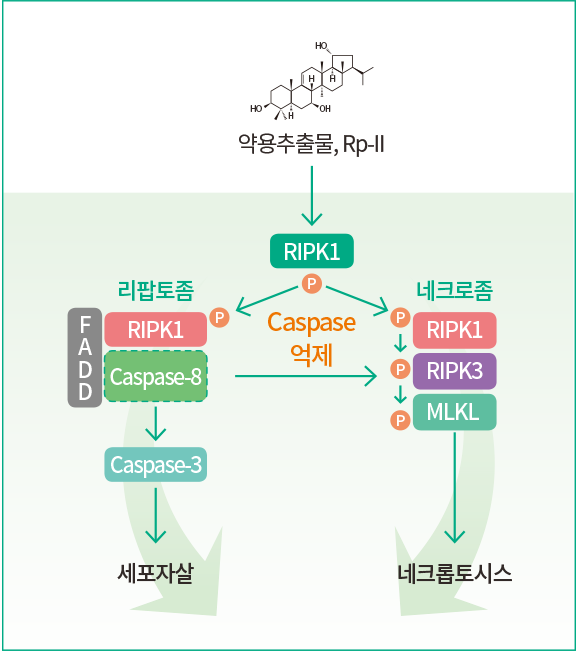 그림 2. 새로운 형태의 죽음 유도제 개발연구 결과
그림 2. 새로운 형태의 죽음 유도제 개발연구 결과